Da die IUPAC-Nomenklatur je nach Art und Zahl der Substituenten zu einer
verwirrenden Vielzahl von Positionsnummern führt, wird hier im
allgemeinen eine Nomenklatur verwendet, die zwar nicht in allen Fällen
dem IUPAC-Standard entspricht, dafür jedoch einen einfacheren Vergleich
zwischen den verschiedenen Verbindungen erlaubt. Die verwendete Numerierung
weist dem Yliden-Kohlenstoff die Nummer 1 zu (wie auch die IUPAC-Nomenklatur
bei den entsprechenden Keto-Verbindungen), während die Doppelbindungen
im Ring an den Positionen 2 und 5 sitzen.
 |
Abb. A1: Nomenklatur (IUPAC-Bezeichnung in Klammern):
I: 2,5-Cyclohexadienon (2,5-Cyclohexadienon),
II: 1-Methylen-2,5-cyclohexadien (3-Methylen-1,4-cyclohexadien),
III: 4,4-Dimethyl-2,5-cyclohexadienon (4,4-Dimethyl-2,5-cyclohexadienon),
IV: 4,4-Dimethyl-1-methylen-2,5-cyclohexadien (3,3-Dimethyl-6-methylen-1,4-cyclohexadien). |
Das Cyclohexadienylidensystem ist aus mehreren Gründen von besonderem
Interesse sowohl für die theoretische als auch für die angewandte
Chemie. Erstens findet sich dieser Grundkörper in Steroiden (z.B.
Prednison, Triamcinolon), Alkaloiden (z.B.: Proaporphine [1] wie Orientalinon und Mecambrin) und anderen
biologisch wichtigen Stoffen [2].
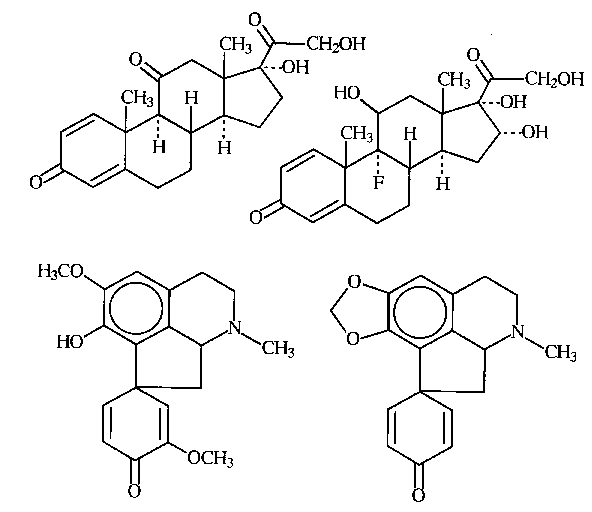 |
Abb. A.2: Biologisch wichtige Verbindungen mit
2,5-Cyclohexadienon-Gruppe: Prednison (links oben),
Triamcinolon (rechts oben), Orientalinon (links unten) und Mecambrin (rechts unten). |
Des weiteren gehören die Vertreter dieser Verbindungsklasse zu den
kreuzkonjugierten Verbindungen, die besonders für die theoretische
organische Chemie interessant sind [3]
(vgl. Kapitel B.3). Außerdem wurde auch
die Photochemie des Cyclohexadienylidensystems eingehend untersucht [4].
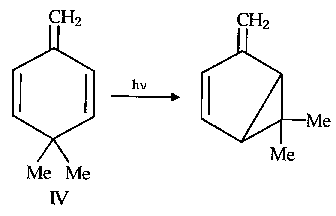 |
| Abb. A.3: Photosiomerisierung von
4,4-Dimethyl-1-methylen-2,5-cyclohexadien (IV). |
Viele Verbindungen mit diesem Grundkörper stellen Tautomere zu
entsprechenden aromatischen Systemen dar. So sind die einfachsten Vertreter
Cyclohexadienon (CHDO, I) und Methylencyclohexadien
(MCHD, II) die
tautomeren Formen von Phenol beziehungsweise Toluol.
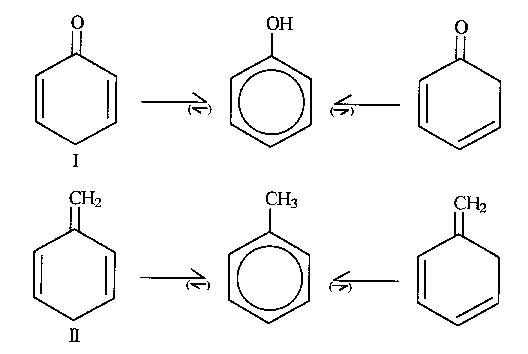 |
| Abb. A.4: Tautomerie von Phenol und
Toluol. |
Aus diesem Grund sind CHDO und MCHD auch nicht stabil. Die aromatischen
Formen liegen energetisch wesentlich tiefer. So beträgt der
Energieunterschied zwischen Phenol und CHDO 42 kJ/mol [5] und zwischen Toluol und MCHD gar 100 kJ/mol [6]. Das thermodynamische Gleichgewicht
liegt also ganz auf Seite der aromatischen Verbindungen und sobald die
(offensichtlich sehr kleine) Aktivierungsenergie zur Verfügung gestellt
wird, setzen sich CHDO und MCHD effektiv irreversibel zu Phenol bzw. Toluol
um.
Aufgrund der Tautomerie tauchen die verschieden substituierten
Grundkörper auch als Zwischenstufen in vielen Reaktionen von
aromatischen Verbindungen auf [7].
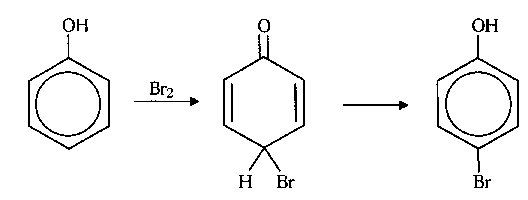 |
| Abb. A.5: Schematischer Ablauf der Bromierung
von Phenol. |
Intuitiv würde man erwarten, daß ein kreuzkonjugiertes
Bindungssystem eben gebaut ist. Diese Erwartung wird bei den
kreuzkonjugierten Fünfring-Verbindungen auch bestätigt:
Cyclopentadienon (V) und Fulven (VI) sind in der Tat eben. Das acyclische Analogon zum
Fulven, das 3-Methylen-1,4-pentadien (VII), ist
zwar nicht eben, dies ist jedoch aufgrund der sterischen Hinderung durch die
zwei "inneren" Vinyl-Wasserstoffatome leicht verständlich.
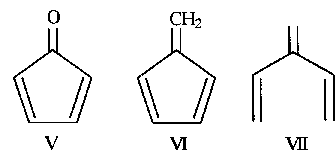 |
Abb. A.6: Einfache Kreuzkonjugierte
Verbindungen: Cyclopentadien (V),
Fulven (VI) und 3-Methylen-1,4,-pentadien
(VII). |
Bei den
kreuzkonjugierten Sechsring-Verbindungen finden sich widersprüchliche
Angaben in der Literatur. So wurden einerseits für g-Pyron (VIII) und seine drei Schwefel-Analoga mittels
Mikrowellenspektroskopie eindeutig planare Ringe nachgewiesen [8]. In der Vergangenheit wurden diesen Pyronen
immer wieder aromatische Eigenschaften zugeschrieben, was durch
entsprechende Resonanzstrukturen auch einleuchtend erklärt werden kann
(vgl. Abb. A.7). Dies würde zu einer
stärkeren Bevorzugung einer planaren Struktur führen. Norris et
al. [9] haben jedoch durch
Zeeman-Effekt-Messungen nachgewiesen, daß die Pyrone (wie auch Tropon)
im wesentlichen als nicht-aromatisch zu betrachten sind. Die Ebenheit der
Pyrone kann also nicht auf teilweise Aromatizität
zurückgeführt werden. Sie nehmen somit in der Betrachtung
kreuzkonjugierter Sechsringverbindungen keine Sonderstellung ein.
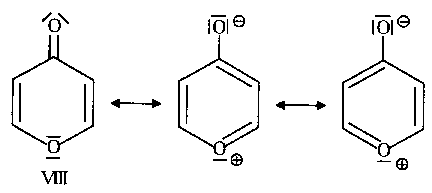 |
| Abb. A.7: Postulierte mesomere Grenzstrukturen
von g-Pyron (VIII). |
Andererseits wurde für 4,4-Dimethyl-1-methylen-2,5-cyclohexadien
(DMMCHD, IV) eine durch Elektronenbeugung
bestimmte nicht-ebene Struktur veröffentlicht [10]. Liotta et al. [11] schreiben sogar ganz allgemein: "sterically,
cyclohexadienones exist as shallow boats", aber diese Behauptung wird weder
durch Literaturverweise belegt, noch konnte in den vielen Artikeln, die im
Laufe dieser Arbeit zusammengetragen wurden, ein Hinweis auf strukturelle
Untersuchungen an Cyclohexadienonen gefunden werden. Der Hinweis auf eine
Wannenstruktur ist jedoch insofern sinnvoll, als dies - im Gegensatz zum
gesättigten Sechsring, der sowohl als Wanne wie auch als Sessel
vorliegen kann (wobei hier die Sesselform energetisch bei weitem
günstiger ist) - die einzig mögliche nicht-ebene Struktur des
para-Cyclohexadienyliden-Systems darstellt (vgl. [12]). Dies liegt an der Versteifung des Ringes
durch die beiden endocyclischen Doppelbindungen. Der Ring verhält sich
also ähnlich wie ein Vierring, weshalb man solche Systeme auch als
"pseudo-Vierringe" bezeichnet.
Die Zahl der Strukturuntersuchungen an kreuzkonjugierten Verbindungen ist
bisher nur gering und, wie oben gezeigt wurde, sind die bisher
veröffentlichten Ergebnisse zum Teil widersprüchlich. Ziel dieser
Arbeit war es deshalb, die (Nicht-)Ebenheit des
para-Cyclohexadienyliden-Systems zu untersuchen. Die hierfür
vorbereitend durchgeführten theoretischen Berechnungen favorisierten
eine ebene Struktur für alle untersuchten
para-Cyclohexadienyliden-Systeme. Zweifel an der korrekten Interpretation
der Elektronenbeugungsdaten [10] von
DMMCHD (IV) waren also angebracht und eine
Klärung der Ebenheitsfrage durch die Mikrowellenspektroskopie erschien
lohnenswert. Nachdem sowohl für Cyclohexadienone allgemein als auch
für DMMCHD im besonderen nicht-ebene Strukturen in der Literatur
auftauchen, sollte je ein Vertreter der Oxo-Verbindungen
(2,5-Cyclohexadienone) und der Methylen-Verbindungen
(1-Methylen-2,5-cyclohexadiene) synthetisiert und mit Hilfe der
Mikrowellenspektroskopie untersucht werden. Während bei den
Methylenverbindungen der einfachste Vertreter gewählt werden konnte,
mußte bei den Oxo-Verbindungen auf ein 4,4-dimethyliertes Molekül
zurückgegriffen werden, da der Versuch des
mikrowellenspektroskopischen Nachweises des 2,5-Cyclohexadienons bereits
früher ohne Erfolg geblieben war [12]. Die beiden Methylgruppen in 4-Position
erschweren zwar eine Aussage über die Ebenheit des Ringes, andererseits
ist so jedoch eine Aussage über einen eventuellen Einfluß dieser
Gruppen auf die Struktur des Ringes möglich.
 Zurück zum Inhaltsverzeichnis
Zurück zum Inhaltsverzeichnis
 Zum nächsten
Kapitel
Zum nächsten
Kapitel







 Zurück zum Inhaltsverzeichnis
Zurück zum Inhaltsverzeichnis